Решебник по химии 10 класс Габриелян | Страница 63
Страница 63
Примените свои знания
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этан → этилен → этиловый спирт → уксусный альдегид
б) метан → хлорметан → метиловый спирт → метиловый эфир уксусной кислоты
в) этиловый спирт → этилен → бромэтан → этиловый спирт → этанат калия
а) этан → этилен → этиловый спирт → уксусный альдегид
CH₃–CH₃ → CH₂=CH₂ + H₂
CH₂=CH₂ + H₂O → CH₃–CH₂OH
CH₃–CH₂OH + CuO → CH₃–CHO + Cu + H₂O
б) метан → хлорметан → метиловый спирт → метиловый эфир уксусной кислоты
CH₄ + Cl₂ → CH₃Cl + HCl
CH₃Cl + NaOH → CH₃OH + NaCl
CH₃COOH + CH₃OH → CH₃COOCH₃ + H₂O
в) этиловый спирт → этилен → бромэтан → этиловый спирт → этанат калия
CH₃–CH₂OH → CH₂=CH₂ + H₂O
CH₂=CH₂ + HBr → CH₃–CH₂Br
CH₃–CH₂Br + NaOH → CH₃–CH₂OH + NaBr
CH₃–CH₂OH + O₂ → CH₃COOH + H₂O
CH₃COOH + KOH → CH₃COOK + H₂O
6. В двух пробирках без подписей находятся метиловый спирт и толуол. Предложите способ распознавания этих веществ. Напишите уравнение реакции.
Для распознавания можно использовать реакцию с натрием (Na).
Метиловый спирт реагирует с натрием с выделением водорода:
(2CH₃OH + 2Na → 2CH₃ONa + H₂↑) — появляется газ.
Толуол — ароматический углеводород, не реагирует с натрием при обычных условиях. Следовательно, в пробирке, где идёт бурное выделение газа, находится метанол. Где реакции нет — толуол.
7. Какой объём водорода (н. у.) получится при действии 6,9 г натрия на 115 мл этилового спирта плотностью 0,80 г/мл?
Вычислим массу этанола:
m = ρ × V = 0,80 г/мл × 115 мл = 92 г
Найдём количество вещества этанола:
M(C₂H₅OH) = 46 г/моль
n(C₂H₅OH) = 92 / 46 = 2 моль
Уравнение реакции:
(2C₂H₅OH + 2Na → 2C₂H₅ONa + H₂↑)
Из 2 моль этанола и 2 моль натрия выделяется 1 моль H₂.
Найдём количество вещества натрия:
M(Na) = 23 г/моль
n(Na) = 6,9 / 23 = 0,3 моль
Реакция идёт в мольном соотношении 2:1 (Na : H₂), значит:
0,3 моль Na → 0,15 моль H₂
Объём водорода (н. у.):
V = n × Vm = 0,15 × 22,4 = 3,36 л
Ответ: объём водорода, который выделится, равен 3,36 литра.
Стр. 63
Выразите свое мнение
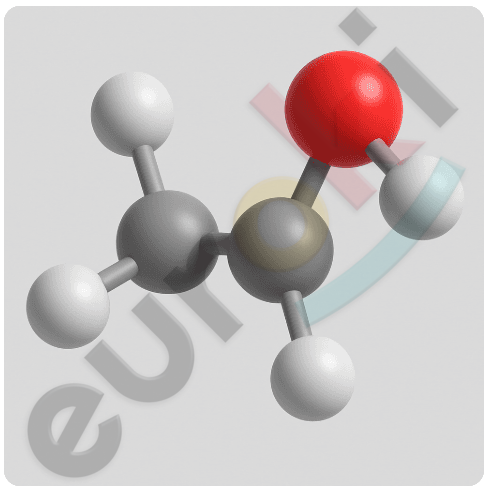
8. Постройте на компьютере 3D-модель молекулы этилового спирта. Рассмотрите взаимное расположение атомов в пространстве. Выскажите и аргументируйте своё мнение о том, является ли расположение атомов C—O—H линейным. Если нет, то определите примерную величину угла.
В молекуле этилового спирта (CH₃–CH₂–OH) атом кислорода связан с атомом углерода и атомом водорода, а также имеет две неподелённые пары электронов. Это придаёт ему изгиб в пространстве, поскольку форма молекулы определяется не только положением атомов, но и электронными парами.
Расположение атомов C—O—H не является линейным, потому что электронные пары кислорода отталкиваются друг от друга и от атомов, образующих связи. Такая геометрия называется изогнутой (или угловой), аналогично молекуле воды.
Примерная величина угла C—O—H составляет около 104–110°, обычно близка к 108°, что подтверждается как экспериментальными данными, так и компьютерным моделированием.
Таким образом, в 3D-модели этанола видно, что угол между атомами C—O—H меньше 180°, и конфигурация не является линейной из-за влияния неподелённых электронных пар кислорода.
Параграф 12. Многоатомные спирты
Стр. 63
Вопрос
1. Анализ названия этого класса органических соединений позволяет прийти к выводу, что их молекулы содержат несколько функциональных гидроксильных групп. Как количество этих групп влияет на свойства многоатомных спиртов?
Многоатомные спирты — это органические соединения, молекулы которых содержат две и более гидроксильных (–OH) группы. С увеличением числа этих групп усиливается влияние водородных связей между молекулами, а значит, повышается растворимость в воде, увеличивается температура кипения, а также изменяется реакционная способность.
Каждая дополнительная –OH группа усиливает гидрофильные свойства молекулы. Это означает, что многоатомные спирты, особенно низшие, очень хорошо растворимы в воде. Например, глицерин (трёхатомный спирт) смешивается с водой в любых соотношениях.
Кроме того, наличие нескольких гидроксильных групп делает такие соединения более реакционноспособными — они активнее взаимодействуют с кислотами, образуя сложные эфиры, и с активными металлами, выделяя водород. Они также могут участвовать в более сложных реакциях окисления.
Таким образом, увеличение числа гидроксильных групп приводит к усилению полярности, способности к водородному связыванию и, как следствие, к значительным изменениям физических и химических свойств многоатомных спиртов по сравнению с одноатомными.

