Решебник по химии 9 класс. Рудзитис ФГОС §2
§2
Тепловые эффекты химических реакций
Стр. 16
Вопросы
1. Вспомните из курса физики, как называют прибор для измерения количества теплоты.
Прибор для измерения количества теплоты называется калориметр. Это устройство, с помощью которого можно измерить количество теплоты, выделяющееся или поглощающееся в ходе физического или химического процесса. Калориметры широко применяются в термохимии, теплотехнике и других областях для проведения точных тепловых измерений.
2. Как рассчитать молярную массу вещества?
Молярную массу вещества рассчитывают как сумму относительных атомных масс всех атомов, входящих в состав одной молекулы вещества. Для этого нужно:
узнать химическую формулу вещества,
определить относительную атомную массу каждого элемента (по таблице Менделеева),
умножить её на число атомов этого элемента в формуле,
сложить все полученные значения.
Пример:
Для воды (H₂O):
А(H) = 1, А(O) = 16
M(H₂O) = 2 × 1 + 16 = 18 г/моль.
Стр. 18
Подумай, ответь, выполни
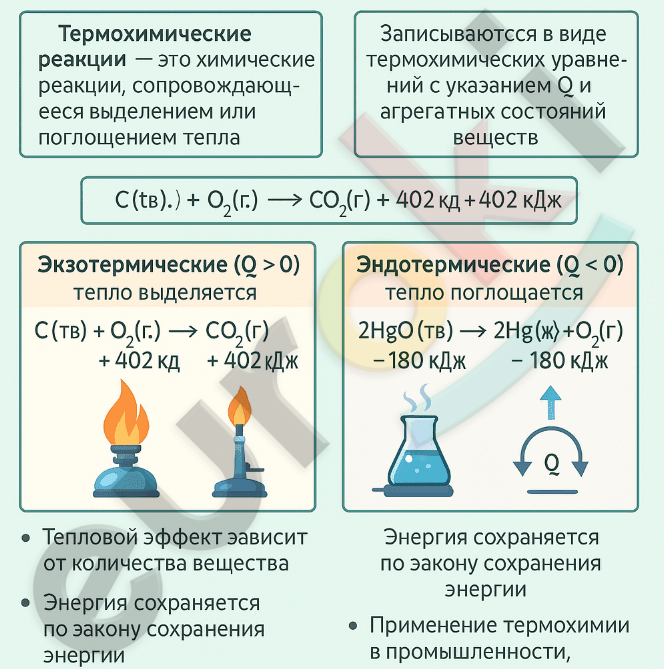
1. Составьте инфографику о термохимических реакциях.
Инфографика о термохимических реакциях должна включать ключевые понятия:
— Термохимические реакции — это химические реакции, сопровождающиеся выделением или поглощением тепла.
— Записываются с указанием теплового эффекта (Q) и агрегатных состояний веществ.
— Делятся на два типа:
Экзотермические (Q > 0, выделяется тепло), например:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
Эндотермические (Q < 0, поглощается тепло), например:
(2HgO(тв.) → 2Hg(ж.) + O₂(г.) – 180 кДж)
Также важно указать:
— Тепловой эффект зависит от количества вещества.
— Энергия сохраняется по закону сохранения энергии.
— Применение термохимии важно в промышленности, энергетике и технике.
2. Какие данные нужно обязательно указывать при составлении термохимических уравнений? Поясните на конкретных примерах.
При составлении термохимических уравнений обязательно указываются:
Агрегатные состояния веществ (тв. — твёрдое, ж. — жидкое, г. — газообразное),
Точные коэффициенты веществ по уравнению,
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся в реакции (обозначается Q или конкретным значением в кДж).
Примеры:
— Экзотермическая реакция:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
— Эндотермическая реакция:
(2NH₃(г.) → N₂(г.) + 3H₂(г.) – 92 кДж)
Если эти данные не указаны, невозможно определить тепловой эффект, агрегатное состояние и направление энергетического обмена.
3. Какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях, в избытке кислорода? Термохимическое уравнение реакции: 2H₂(г.) + O₂(г.) = 2H₂O(г.) + 484 кДж
При нормальных условиях 1 моль любого газа занимает 22,4 л.
Значит, 100 л водорода — это:
100 л / 22,4 л/моль = 4,464 моль H₂ (округлим: 4,464 моль)
Из уравнения видно:
2 моль H₂ → 484 кДж,
тогда 4,464 моль H₂ → X кДж:
X = (484 × 4,464) / 2 = 1081,4 кДж
Ответ: при сжигании 100 л водорода выделится 1081,4 кДж теплоты.
4. Вычислите, сколько сгорело угля, если при этом выделилось 33 520 кДж теплоты.
Используем термохимическое уравнение:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
1 моль угля (12 г) даёт 402 кДж.
Найдём, сколько моль угля сгорело:
33 520 кДж / 402 кДж = 83,42 моль
Теперь массу:
83,42 моль × 12 г/моль = 1001 г
Ответ: сгорело 1001 г угля.






