Решебник по химии 9 класс. Рудзитис ФГОС §22
§22
Оксид серы. Сернистая кислота
Стр. 89
Вопросы
1. Какие вещества называют оксидами?
Оксидами называют сложные вещества, состоящие из двух элементов, один из которых обязательно кислород в степени окисления –2. Оксиды образуются при соединении элементов с кислородом, чаще всего — при горении веществ на воздухе.
2. Как классифицируют оксиды?
Оксиды классифицируют по химическим свойствам на:
основные (например, Na₂O, CaO) — взаимодействуют с кислотами;
кислотные (например, SO₂, CO₂) — взаимодействуют с щелочами;
амфотерные (например, ZnO, Al₂O₃) — могут реагировать и с кислотами, и с щелочами;
несолеобразующие (например, CO, N₂O) — не образуют солей при взаимодействии с кислотами или щелочами.
Стр. 90
Лабораторный опыт
В пробирку с раствором сульфита натрия добавьте 1 мл раствора серной кислоты.
Отметьте признаки проведённой вами химической реакции:
При добавлении серной кислоты к раствору сульфита натрия наблюдается выделение газа с резким запахом — это диоксид серы (сернистый газ) SO₂. Также может наблюдаться лёгкое помутнение или вспенивание. Это указывает на химическую реакцию между сульфит-ионами и ионами водорода.
Составьте молекулярное, ионное и сокращённое ионное уравнения реакции:
Молекулярное уравнение:
(Na₂SO₃ + H₂SO₄ → Na₂SO₄ + SO₂↑ + H₂O)
Полное ионное уравнение:
(2Na⁺ + SO₃²⁻ + 2H⁺ + SO₄²⁻ → 2Na⁺ + SO₄²⁻ + SO₂↑ + H₂O)
Сокращённое ионное уравнение:
(SO₃²⁻ + 2H⁺ → SO₂↑ + H₂O)
Вывод:
Образование газа с характерным запахом подтверждает присутствие сульфит-ионов в растворе.
Стр. 91
Подумай, ответь, выполни
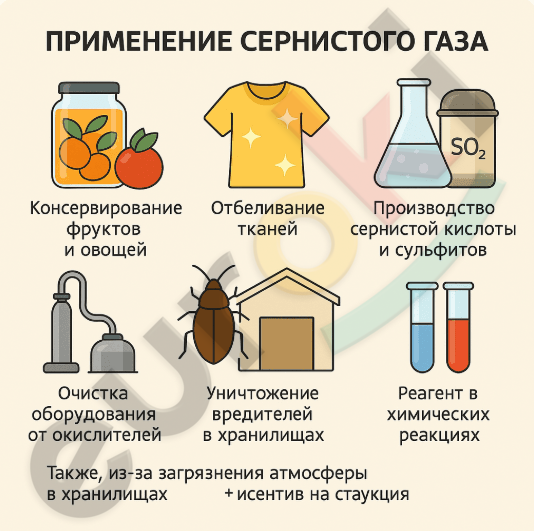
1. Составьте инфографику о применении сернистого газа. Обсудите её с соседом по парте.
Сернистый газ (SO₂) обладает отбеливающими и дезинфицирующими свойствами, поэтому используется в различных отраслях промышленности и в быту. Он применяется: — в пищевой промышленности для консервирования фруктов и овощей; — в текстильной промышленности для отбеливания тканей; — в бумажной промышленности для отбеливания целлюлозы; — в производстве сернистой кислоты (H₂SO₃) и сульфитов; — как реагент для очистки оборудования от кислородсодержащих соединений; — для уничтожения вредителей в хранилищах; — в качестве антиоксиданта; — как реагент при лабораторных и промышленных химических реакциях.
Также, из-за загрязнения атмосферы SO₂ является участником кислотных дождей, что вредно сказывается на экологии.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: S → H₂S → SO₂ → Na₂SO₃ → BaSO₃ → SO₂
Уравнения реакций ионного обмена напишите в полном и сокращённом ионном виде.
(S + H₂ → H₂S) — получение сероводорода из серы.
(2H₂S + 3O₂ → 2SO₂ + 2H₂O) — окисление сероводорода до диоксида серы.
(SO₂ + 2NaOH → Na₂SO₃ + H₂O) — взаимодействие SO₂ с щёлочью, образование сульфита натрия.
Полное ионное уравнение: (SO₂ + 2Na⁺ + 2OH⁻ → 2Na⁺ + SO₃²⁻ + H₂O)
Сокращённое ионное уравнение: (SO₂ + 2OH⁻ → SO₃²⁻ + H₂O)
(Na₂SO₃ + BaCl₂ → BaSO₃↓ + 2NaCl) — получение сульфита бария.
Полное ионное уравнение: (2Na⁺ + SO₃²⁻ + Ba²⁺ + 2Cl⁻ → BaSO₃↓ + 2Na⁺ + 2Cl⁻)
Сокращённое ионное уравнение: (Ba²⁺ + SO₃²⁻ → BaSO₃↓)
(BaSO₃ + 2HCl → SO₂ + BaCl₂ + H₂O) — разложение сульфита под действием кислоты.
Полное ионное уравнение: (BaSO₃ + 2H⁺ + 2Cl⁻ → SO₂ + Ba²⁺ + 2Cl⁻ + H₂O)
Сокращённое ионное уравнение: (BaSO₃ + 2H⁺ → SO₂ + Ba²⁺ + H₂O)
3. Используя Интернет и дополнительную литературу, подготовьте презентацию из шести–семи слайдов на тему «Кислотные дожди».
4. Определите объём сероводорода (н. у.), образовавшегося при реакции соляной кислоты с 2 кг сульфида железа(II), содержащего 10 % примесей.
Найдём массу чистого FeS:
(2 кг = 2000 г)
10 % примесей → 90 % FeS
(2000 г × 0,9 = 1800 г FeS)
Рассчитаем количество вещества FeS:
М(FeS) = 55,85 + 32,06 = 87,91 г/моль
n(FeS) = 1800 г / 87,91 г/моль ≈ 20,47 моль
Уравнение реакции:
(FeS + 2HCl → FeCl₂ + H₂S↑)
Из уравнения видно: 1 моль FeS → 1 моль H₂S
n(H₂S) = 20,47 моль
Объём газа при н.у.:
V = n × Vm = 20,47 моль × 22,4 л/моль ≈ 458,5 л
Ответ: Объём сероводорода, выделившегося при реакции, составляет приблизительно 458,5 л (н.у.).
Стр. 91
Тестовые задания
1. Для получения оксида серы (IV) нельзя использовать химическую реакцию
S + O₂ →
H₂S + O₂ →
Na₂SO₄ →
Na₂SO₃ + HCl →
Правильный вариант — 3) Na₂SO₄ →
Пояснение: сульфат натрия (Na₂SO₄) — соль серной кислоты и термически устойчивое вещество, не разлагается с образованием оксида серы (IV). Остальные реакции действительно приводят к образованию SO₂.
2. В техническом хлориде натрия содержится примесь сульфита натрия. Обнаружить эту примесь можно с помощью раствора
гидроксида калия
сульфида калия
серной кислоты
карбоната калия
Правильный вариант — 3) серной кислоты
Пояснение: при добавлении серной кислоты к сульфиту натрия происходит реакция с выделением сернистого газа с резким запахом:
(Na₂SO₃ + H₂SO₄ → SO₂ + Na₂SO₄ + H₂O) — это качественная реакция на сульфит-ион.






