Решебник по химии 9 класс. Рудзитис ФГОС | Страница 113
Страница 113
Подумай, ответь, выполни
1. Объясните, почему азотную кислоту относят к кислотам-окислителям. Какие ещё кислоты-окислители вам известны? Можно ли отнести к подобным кислотам соляную кислоту? Обсудите этот вопрос с соседом по парте.
Азотная кислота (HNO₃) содержит атом азота в высшей степени окисления +5, что позволяет ей легко принимать электроны и, следовательно, проявлять окислительные свойства. Она способна окислять даже такие вещества, которые не взаимодействуют с обычными кислотами, например медь и серебро.
Кислотами-окислителями также являются концентрированная серная кислота (H₂SO₄), перхлорная кислота (HClO₄) и хлорноватая кислота (HClO₃).
Соляная кислота (HCl) не относится к кислотам-окислителям, так как ион Cl⁻ находится в низшей степени окисления –1 и не может выступать в роли окислителя.
2. При взаимодействии разбавленной азотной кислоты с цинком выделяется азот. Напишите соответствующее уравнение окислительно-восстановительной реакции.
Уравнение реакции: (4Zn + 10HNO₃ → 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O)
Здесь:
Цинк (Zn⁰) окисляется до иона (Zn²⁺) в составе соли (Zn(NO₃)₂).
Ион нитрата (NO₃⁻) восстанавливается до иона аммония (NH₄⁺).
3. Напишите молекулярные, полные и сокращённые ионные уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты.
Для различения соляной кислоты (HCl): используем реакцию с нитратом серебра (AgNO₃):
(HCl + AgNO₃ → AgCl↓ + HNO₃)
Полное ионное: (H⁺ + Cl⁻ + Ag⁺ + NO₃⁻ → AgCl↓ + H⁺ + NO₃⁻)
Сокращённое ионное: (Ag⁺ + Cl⁻ → AgCl↓)
Для различения серной кислоты (H₂SO₄): используем реакцию с раствором солей бария (BaCl₂):
(H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl)
Сокращённое ионное: (Ba²⁺ + SO₄²⁻ → BaSO₄↓)
Для различения азотной кислоты (HNO₃): окислительно-восстановительная реакция с медью:
(3Cu + 8HNO₃(разб.) → 3Cu(NO₃)₂ + 2NO↑ + 4H₂O)
4. Приведите уравнения реакций: а) характерных только для азотной кислоты; б) общих для азотной и других кислот.
а) Характерные только для HNO₃ (окислительно-восстановительная реакция):
(Cu + 4HNO₃(конц.) → Cu(NO₃)₂ + 2NO₂↑ + 2H₂O)
б) Общая для всех сильных кислот:
(HNO₃ + NaOH → NaNO₃ + H₂O)
5. Напишите уравнения реакций, протекающих между серебром и разбавленной, а также концентрированной азотной кислотой. Покажите переход электронов и подберите окислитель одной чертой, а восстановитель — двумя.
С концентрированной HNO₃:
(Ag + 2HNO₃(конц.) → AgNO₃ + NO₂↑ + H₂O)
Окислитель — HNO₃ (азот в степени окисления +5),
Восстановитель — Ag⁰.
С разбавленной HNO₃:
(3Ag + 4HNO₃(разб.) → 3AgNO₃ + NO↑ + 2H₂O)
Окислитель — HNO₃,
Восстановитель — Ag.
Переход электронов:
Ag⁰ – 1e⁻ → Ag⁺
N⁺⁵ + 3e⁻ → N⁺²
6. Используя рисунок 25, подготовьте инфографику на тему «Применение азотной кислоты».
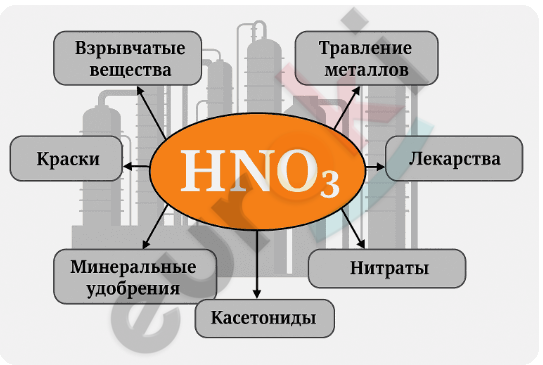
7. Какой объём аммиака (н. у.) потребуется для получения 50 г раствора с массовой долей азотной кислоты 0,5?
Масса чистой азотной кислоты в растворе:
(0,5 × 50 г = 25 г)
Количество вещества (n) HNO₃:
(n = 25 г / 63 г/моль ≈ 0,397 моль)
Уравнение реакции синтеза аммиака:
(NH₃ + 2O₂ → HNO₃ + H₂O) — условно
Для упрощения расчёта, считаем, что на 1 моль HNO₃ нужно 1 моль NH₃.
Значит, требуется 0,397 моль NH₃.
Объём NH₃ (н. у.):
(V = n × 22,4 л/моль = 0,397 × 22,4 ≈ 8,9 л)
Ответ: необходимо примерно 9 л аммиака (при н. у.) для получения 50 г раствора с массовой долей 0,5.
Стр. 113
Тестовые задания
1. Установите соответствие между исходными веществами и продуктами реакции.
HNO₃ →
NH₄NO₃ + KOH →
Cu(NO₃)₂ + KOH →
Zn(NO₃)₂(тв.) + H₂SO₄(конц.) →
А. NH₄NO₃ + KNO₃ + H₂O
Б. HNO₃ + ZnSO₄
В. ZnSO₄ + H₂
Г. NO₂ + O₂ + H₂O
Д. Cu(OH)₂ + KNO₃
HNO₃ → А. NH₄NO₃ + KNO₃ + H₂O
Это уравнение реакции азотной кислоты с аммиаком, в результате которой образуется аммонийная соль (NH₄NO₃) и нитрат калия (KNO₃) с образованием воды.
NH₄NO₃ + KOH → Б. HNO₃ + ZnSO₄
Здесь происходит реакция аммонийной соли с гидроксидом калия, в результате чего выделяется кислота (HNO₃) и образуется сульфат цинка (ZnSO₄) через химическую реакцию нейтрализации.
Cu(NO₃)₂ + KOH → В. ZnSO₄ + H₂
Это реакция сульфата меди с гидроксидом калия, в результате которой появляется водород, а также образуется сульфат меди и вода.
Zn(NO₃)₂(тв.) + H₂SO₄(конц.) → Г. NO₂ + O₂ + H₂O
Здесь в реакции сульфата цинка с концентрированной серной кислотой выделяются оксид азота (NO₂), кислород (O₂) и вода (H₂O), что подтверждается реакцией с выделением газов.
Таким образом, правильное распределение веществ по реакции:
HNO₃ → А. NH₄NO₃ + KNO₃ + H₂O
NH₄NO₃ + KOH → Б. HNO₃ + ZnSO₄
Cu(NO₃)₂ + KOH → В. ZnSO₄ + H₂
Zn(NO₃)₂ + H₂SO₄ → Г. NO₂ + O₂ + H₂O
2. Азотная кислота не взаимодействует
с оксидом углерода(IV)
с оксидом меди(II)
с карбонатом натрия
с гидроксидом алюминия
Азотная кислота не взаимодействует с:
с оксидом углерода(IV)
Пояснение: Азотная кислота не реагирует с углекислым газом (CO₂), так как CO₂ — это слабый окислитель.
с оксидом меди(II)
Пояснение: Азотная кислота реагирует с оксидом меди(II) с образованием нитратов меди.
с карбонатом натрия
Пояснение: Азотная кислота не реагирует с карбонатом натрия, так как они не образуют нерастворимого осадка.
с гидроксидом алюминия
Пояснение: В обычных условиях гидроксид алюминия не реагирует с азотной кислотой.
Стр. 113
С помощью Интернета
1. Используя Интернет, ознакомьтесь с видеофрагментами, иллюстрирующими взаимодействие концентрированной азотной кислоты с медью.

При взаимодействии меди с концентрированной азотной кислотой происходит окислительно-восстановительная реакция, в которой медь окисляется, а азотная кислота восстанавливается.
Cu + 4HNO₃ → Cu(NO₃)₂ + 2NO₂↑ + 2H₂O Химическое уравнение реакции:
Пояснение:
Вступает в реакцию с концентрированной азотной кислотой (HNO₃), образуя нитрат меди(II) (Cu(NO₃)₂).Медь (Cu)
В процессе реакции выделяется бурый газ диоксид азота (NO₂), который является токсичным и имеет резкий запах.
Также образуется вода (H₂O).
Наблюдаемые явления:
Выделение бурого газа (NO₂)
Появление синего или зелёного окрашивания раствора из-за образования нитрата меди(II)
Повышение температуры раствора (экзотермическая реакция)
Меры предосторожности:
Реакцию следует проводить в хорошо проветриваемом помещении или под вытяжкой.
Используйте средства индивидуальной защиты: перчатки, защитные очки, лабораторный халат.
Избегайте вдыхания паров диоксида азота, так как он токсичен.
Это классический пример окислительно-восстановительной реакции, демонстрирующий свойства концентрированной азотной кислоты как сильного окислителя.
Параграф 30. Соли азотной кислоты






