Решебник по химии 9 класс. Рудзитис ФГОС | Страница 18
Страница 18
Подумай, ответь, выполни
1. Составьте инфографику о термохимических реакциях.
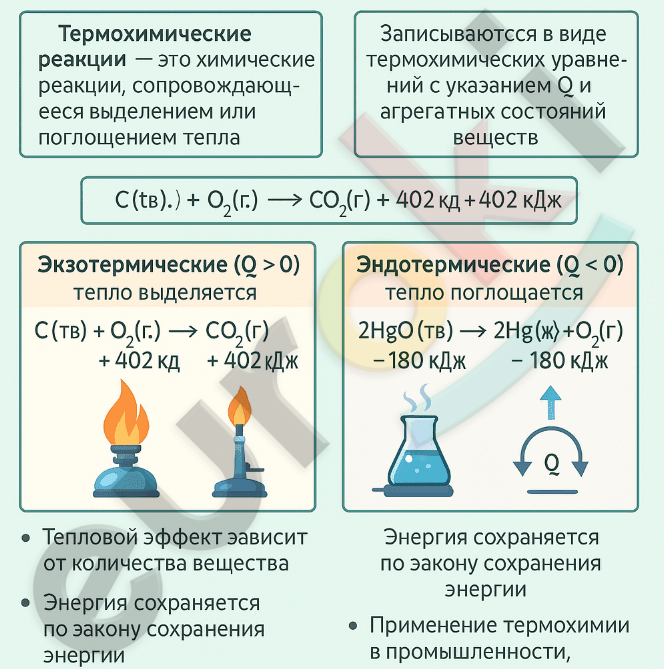
Инфографика о термохимических реакциях должна включать ключевые понятия:
— Термохимические реакции — это химические реакции, сопровождающиеся выделением или поглощением тепла.
— Записываются с указанием теплового эффекта (Q) и агрегатных состояний веществ.
— Делятся на два типа:
Экзотермические (Q > 0, выделяется тепло), например:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
Эндотермические (Q < 0, поглощается тепло), например:
(2HgO(тв.) → 2Hg(ж.) + O₂(г.) – 180 кДж)
Также важно указать:
— Тепловой эффект зависит от количества вещества.
— Энергия сохраняется по закону сохранения энергии.
— Применение термохимии важно в промышленности, энергетике и технике.
2. Какие данные нужно обязательно указывать при составлении термохимических уравнений? Поясните на конкретных примерах.
При составлении термохимических уравнений обязательно указываются:
Агрегатные состояния веществ (тв. — твёрдое, ж. — жидкое, г. — газообразное),
Точные коэффициенты веществ по уравнению,
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся в реакции (обозначается Q или конкретным значением в кДж).
Примеры:
— Экзотермическая реакция:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
— Эндотермическая реакция:
(2NH₃(г.) → N₂(г.) + 3H₂(г.) – 92 кДж)
Если эти данные не указаны, невозможно определить тепловой эффект, агрегатное состояние и направление энергетического обмена.
3. Какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях, в избытке кислорода? Термохимическое уравнение реакции: 2H₂(г.) + O₂(г.) = 2H₂O(г.) + 484 кДж
При нормальных условиях 1 моль любого газа занимает 22,4 л.
Значит, 100 л водорода — это:
100 л / 22,4 л/моль = 4,464 моль H₂ (округлим: 4,464 моль)
Из уравнения видно:
2 моль H₂ → 484 кДж,
тогда 4,464 моль H₂ → X кДж:
X = (484 × 4,464) / 2 = 1081,4 кДж
Ответ: при сжигании 100 л водорода выделится 1081,4 кДж теплоты.
4. Вычислите, сколько сгорело угля, если при этом выделилось 33 520 кДж теплоты.
Используем термохимическое уравнение:
(C(тв.) + O₂(г.) → CO₂(г.) + 402 кДж)
1 моль угля (12 г) даёт 402 кДж.
Найдём, сколько моль угля сгорело:
33 520 кДж / 402 кДж = 83,42 моль
Теперь массу:
83,42 моль × 12 г/моль = 1001 г
Ответ: сгорело 1001 г угля.
Параграф 3. Скорость химических реакций






