Решебник по химии 9 класс. Рудзитис ФГОС §17
§17
Соляная кислота и ее соли
Стр. 74
Вопросы
1. Как можно получить хлороводород в школьной лаборатории?
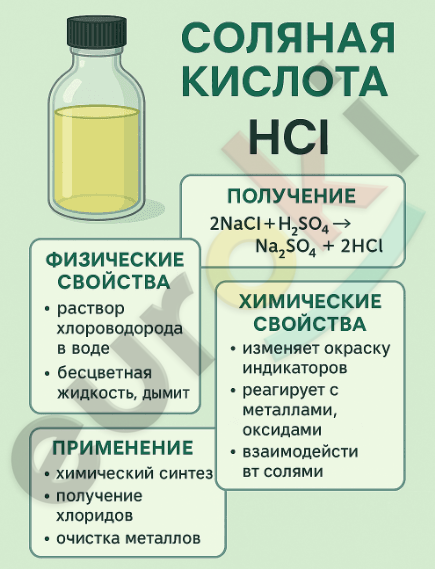
В школьной лаборатории хлороводород получают при взаимодействии твёрдого хлорида натрия (поваренной соли) с концентрированной серной кислотой. Реакцию проводят в специальной пробирке с отводной трубкой, которая направляется в сосуд с водой для сбора газа или получения соляной кислоты.
Химическое уравнение реакции:
(2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl↑)
2. Какие общие свойства характерны для кислот?
Общие свойства кислот: – кислый вкус (в растворах);
– изменение окраски индикаторов (лакмус становится красным, метилоранж — розовым);
– реакция с основаниями с образованием соли и воды (нейтрализация);
– реакция с основными и амфотерными оксидами;
– взаимодействие с солями и металлами (с выделением водорода — для активных металлов).
Пример: (2HCl + Zn → ZnCl₂ + H₂↑)
3. Повторите свойства кислот и солей с позиции теории электролитической диссоциации.
Согласно теории электролитической диссоциации, кислоты в водном растворе распадаются (диссоциируют) на положительные ионы водорода (H⁺) и отрицательные кислотные остатки. Например:
(HCl ⇄ H⁺ + Cl⁻)
Соли диссоциируют на катионы металлов и анионы кислотных остатков.
Например: (NaCl ⇄ Na⁺ + Cl⁻)
Свойства кислот с этой точки зрения объясняются наличием ионов H⁺, которые: – вступают в реакцию с OH⁻ (основания), образуя воду: (H⁺ + OH⁻ → H₂O);
– замещаются катионами металлов при реакции с ними (в случае активных металлов);
– взаимодействуют с основными и амфотерными оксидами, приводя к образованию воды и солей.
Таким образом, кислотные свойства — это, прежде всего, поведение ионов H⁺ в растворе, а свойства солей — результат взаимодействия ионов различных типов в растворах.
Стр. 76
Подумай, ответь, выполни
1. Даны следующие вещества: Zn, Cu, Al, CaO, SiO₂, Fe₂O₃, NaOH, Al(OH)₃, Fe₂(SO₄)₃, CaCO₃, Fe(NO₃)₃. Какие из этих веществ реагируют с соляной кислотой? Составьте уравнения соответствующих реакций.
С соляной кислотой реагируют: – металлы: Zn, Al
(2HCl + Zn → ZnCl₂ + H₂)
(6HCl + 2Al → 2AlCl₃ + 3H₂)
– основные и амфотерные оксиды: CaO, Fe₂O₃, Al(OH)₃
(2HCl + CaO → CaCl₂ + H₂O)
(6HCl + Fe₂O₃ → 2FeCl₃ + 3H₂O)
(3HCl + Al(OH)₃ → AlCl₃ + 3H₂O)
– основания: NaOH
(HCl + NaOH → NaCl + H₂O)
– карбонаты: CaCO₃
(2HCl + CaCO₃ → CaCl₂ + CO₂↑ + H₂O)
С остальными веществами — Cu, SiO₂, Fe₂(SO₄)₃, Fe(NO₃)₃ — соляная кислота при обычных условиях не реагирует, так как они либо инертны (Cu), либо уже являются солями или оксидами кислотного характера.
2. Хлороводород, который получили при взаимодействии избытка концентрированной серной кислоты с 58,5 г хлорида натрия, растворили в 146 г воды. Определите массовую долю хлороводорода (в процентах) в полученном растворе.
Уравнение реакции:
(2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl)
Молярная масса NaCl = 58,5 г/моль → из 58,5 г NaCl получится 1 моль HCl.
Молярная масса HCl = 36,5 г/моль → m(HCl) = 36,5 г
Общая масса раствора = 36,5 г (HCl) + 146 г (вода) = 182,5 г
Массовая доля HCl = (36,5 / 182,5) × 100% ≈ 20%
Ответ: массовая доля хлороводорода в растворе составляет 20%
3. В одном объёме воды при комнатной температуре растворяется примерно 500 объёмов хлороводорода. Вычислите массовую долю хлороводорода (в процентах) в полученном растворе.
1 объём воды — примем как 1 л, масса ≈ 1000 г
500 объёмов хлороводорода при н. у. — это 500 × 22,4 = 11200 л (но при таких расчётах обычно принимают 1 л воды растворяет 500 л газа)
Найдём массу 500 л HCl (н. у.):
1 моль HCl = 22,4 л
n(HCl) = 500 / 22,4 ≈ 22,32 моль
m(HCl) = 22,32 × 36,5 ≈ 815,7 г
Общая масса раствора = 1000 г (вода) + 815,7 г (HCl) = 1815,7 г
Массовая доля = (815,7 / 1815,7) × 100% ≈ 45%
Ответ: массовая доля хлороводорода в насыщенном растворе составляет примерно 45%
4. Составьте инфографику о соляной кислоте и её свойствах.
Стр. 76
Тестовые задания
1. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, характеризующих свойства соляной кислоты.
HCl + Zn →
HCl + MgO →
HCl + Ca(OH)₂ →
HCl + AgNO₃ →
А. Mg(OH)₂ + Cl₂
Б. H₂O + CaCl₂
В. H₂ + ZnCl₂
Г. H₂O + MgCl₂
Д. AgCl + HNO₃
Ответ:
1 — В
2 — Г
3 — Б
4 — Д
Объяснение:
HCl + Zn → H₂ + ZnCl₂ — реакция металла с кислотой, выделяется водород.
HCl + MgO → H₂O + MgCl₂ — реакция оксида с кислотой, образуется соль и вода.
HCl + Ca(OH)₂ → H₂O + CaCl₂ — реакция кислоты с основанием (нейтрализация).
HCl + AgNO₃ → AgCl + HNO₃ — качественная реакция на хлорид-ион: образуется белый осадок AgCl.
2. Различить галогеноводородные кислоты и их соли можно с помощью одного реактива. Этот реактив —
хлорная вода
нитрат серебра
крахмальный клейстер
медь
Ответ: 2) нитрат серебра
Объяснение:
Нитрат серебра (AgNO₃) используется для качественного определения хлорид-ионов (Cl⁻), входящих в состав галогеноводородных кислот и их солей. При взаимодействии с раствором, содержащим ионы Cl⁻, образуется характерный белый осадок AgCl:
(Ag⁺ + Cl⁻ → AgCl↓)
Это позволяет отличить хлороводород и его соли от других веществ.






