Решебник по химии 9 класс. Рудзитис ФГОС §27
§27
Практическая работа 4
Стр. 105
Вопросы
1. Вспомните правила техники безопасности при работе в химическом кабинете.
Правила техники безопасности при работе в химическом кабинете:
Работать только с разрешения учителя и строго по инструкции.
Не пробовать вещества на вкус, не нюхать их прямо из пробирки (только осторожно подносить пары рукой).
Надевать халат, очки и перчатки, особенно при работе с кислотами, щелочами и летучими веществами.
Не наклоняться низко над пробиркой при нагревании — вещество может выплеснуться.
При попадании вещества на кожу или в глаза — немедленно сообщить учителю и промыть водой.
Все отходы и остатки реактивов утилизировать только в специально отведённые места.
Не включать горелки и приборы самостоятельно.
После опыта тщательно вымыть руки с мылом, навести порядок на рабочем месте.
Стр. 105
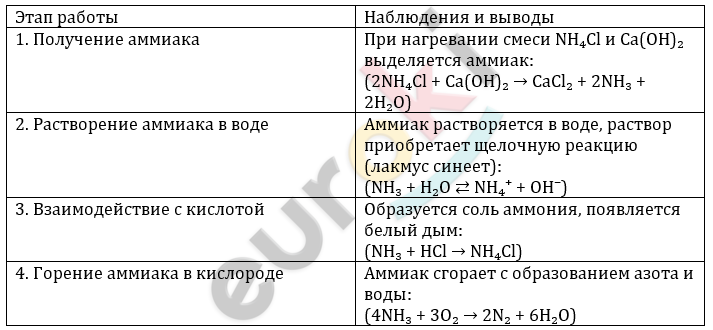
Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде
– При нагревании смеси хлорида аммония (NH₄Cl) и гидроксида кальция (Ca(OH)₂) выделяется аммиак:
(2NH₄Cl + Ca(OH)₂ → CaCl₂ + 2NH₃↑ + 2H₂O)
– Аммиак, попадая в воду, частично реагирует с ней по уравнению:
(NH₃ + H₂O ⇄ NH₄⁺ + OH⁻)
– Появление резкого запаха и синяя окраска лакмуса свидетельствуют о щелочной среде раствора.
– Это объясняется с позиции электролитической диссоциации: аммиак принимает протон от воды, образуя ионы NH₄⁺ и OH⁻.
– При добавлении кислоты (например, HCl), происходит реакция нейтрализации:
(NH₃ + HCl → NH₄Cl)
2. Горение аммиака в кислороде
– При нагревании аммиак в атмосфере кислорода горит с появлением светящегося пламени.
– Основные продукты реакции:
(4NH₃ + 3O₂ → 2N₂ + 6H₂O)
– В реакции аммиак окисляется (N: –3 → 0), кислород восстанавливается (O: 0 → –2).
– Окислитель — O₂, восстановитель — NH₃.
– В результате горения выделяется тепло и образуется вода и азот.
3. Взаимодействие аммиака с кислотами
– Аммиак реагирует с кислотами как основание, образуя соли аммония:
(NH₃ + HCl → NH₄Cl)
– Это кислотно-основное взаимодействие, где аммиак принимает протон от кислоты.
– В лабораторных условиях появляется белый дым — это частицы хлорида аммония NH₄Cl.
– Реакция протекает по донорно-акцепторному механизму.
– Пример уравнения:
(NH₃ (г) + HCl (г) → NH₄Cl (тв.))
4. Отчёт о работе оформите в виде таблицы