Решебник по химии 9 класс. Рудзитис ФГОС §32
§32
Оксид фосфора. Фосфорная кислота и ее соли
Стр. 124
Вопросы
1. Какие вещества называют гигроскопичными? Приведите примеры.
Гигроскопичными называют вещества, которые способны впитывать влагу из воздуха. Это происходит за счёт высокой способности притягивать и удерживать молекулы воды. Примеры: оксид фосфора(V) (P₂O₅), концентрированная серная кислота (H₂SO₄), хлорид кальция (CaCl₂), гидроксид натрия (NaOH). Такие вещества хранят в герметично закрытых сосудах.
2. Какие кислоты и почему относят к кислотам-окислителям?
К кислотам-окислителям относят те, в составе которых есть элемент в высокой степени окисления, способный принимать электроны и тем самым окислять другие вещества. Примеры: азотная кислота (HNO₃) и концентрированная серная кислота (H₂SO₄). Азот в HNO₃ имеет степень окисления +5 и может восстанавливаться до NO₂, NO и т. д., выступая как окислитель.
Стр. 128
Лабораторный опыт
1. Ознакомление с азотными и фосфорными удобрениями.
При проведении реакции между нитратом натрия, концентрированной серной кислотой и медной стружкой выделяется бурый газ — диоксид азота. Появление синего окрашивания раствора объясняется образованием ионов меди(II), которые окрашивают раствор в характерный голубовато-синий цвет. В ходе реакции медь окисляется, переходя из степени окисления 0 в +2, а азот из состава ионов нитрата восстанавливается из степени окисления +5 до +4. Таким образом, окислителем является нитрат-ион (азот), а восстановителем — медь. Азотные удобрения, содержащие нитрат-ион, можно определить по выделению бурого газа при взаимодействии с концентрированной серной кислотой и медью, а наличие ионов аммония — по выделению аммиака с характерным запахом при нагревании с щелочью.
Фосфорные минеральные удобрения можно различить по их растворимости в воде: дигидрофосфат кальция хорошо растворим, гидрофосфат — умеренно, а фосфат кальция практически нерастворим. Фосфат-ион определяется по реакции с раствором нитрата серебра: при этом выпадает характерный жёлтый осадок фосфата серебра, что служит качественной реакцией на фосфаты. Также можно использовать раствор хлорида кальция: если удобрение содержит фосфат- или гидрофосфат-ион, выпадает белый осадок, в то время как органические кислоты или их соли осадка не дают. Растворы фосфорной кислоты изменяют цвет индикатора, демонстрируя ступенчатую диссоциацию: сначала отщепляется один ион водорода, затем второй и третий, что говорит о её трёхосновности. Всё это позволяет достоверно определить состав и тип удобрения, выявляя наличие фосфатных ионов.
Стр. 129
Подумай, ответь, выполни
1. Составьте молекулярные и ионные уравнения реакций фосфорной кислоты:
а) с кальцием;
б) с оксидом кальция;
в) с гидроксидом кальция, взятым в избытке; в недостатке.
Под формулами запишите названия соответствующих веществ.
а) Реакция с кальцием:
Молекулярное:
(2H₃PO₄ + 3Ca → Ca₃(PO₄)₂ + 3H₂↑)
Фосфорная кислота + кальций → фосфат кальция + водород
Ионное:
(6H⁺ + 2PO₄³⁻ + 3Ca → Ca₃(PO₄)₂↓ + 3H₂↑)
б) Реакция с оксидом кальция:
Молекулярное:
(2H₃PO₄ + 3CaO → Ca₃(PO₄)₂ + 3H₂O)
Фосфорная кислота + оксид кальция → фосфат кальция + вода
Ионное:
(6H⁺ + 2PO₄³⁻ + 3Ca²⁺ + 3O²⁻ → Ca₃(PO₄)₂↓ + 3H₂O)
в) С гидроксидом кальция:
Недостаток основания (образуется гидрофосфат кальция):
Молекулярное:
(H₃PO₄ + Ca(OH)₂ → CaHPO₄ + 2H₂O)
Фосфорная кислота + гидроксид кальция → гидрофосфат кальция + вода
Ионное:
(H⁺ + H₂PO₄⁻ + Ca²⁺ + 2OH⁻ → CaHPO₄↓ + 2H₂O)
Избыток основания (образуется дигидрофосфат кальция):
Молекулярное:
(2H₃PO₄ + 3Ca(OH)₂ → Ca₃(PO₄)₂ + 6H₂O)
или
(H₃PO₄ + Ca(OH)₂ (избыток) → Ca(H₂PO₄)₂ + 2H₂O)
в зависимости от соотношения.
2. Составьте уравнения реакций согласно схеме 10. Обсудите выполнение задания с соседом по парте.
Схема 10:
Фосфор →
→ Оксид фосфора(V):
(4P + 5O₂ → 2P₂O₅)
→ Фосфорная кислота:
(P₂O₅ + 3H₂O → 2H₃PO₄)
→ Фосфаты:
(2H₃PO₄ + 3Ca(OH)₂ → Ca₃(PO₄)₂ + 6H₂O)
→ Фосфиды:
(3Ca + 2P → Ca₃P₂)
→ Фосфин:
(Ca₃P₂ + 6H₂O → 3Ca(OH)₂ + 2PH₃)
3. Сколько фосфорной кислоты можно получить из 31 т фосфата кальция, содержащего 20 % примесей?
Масса чистого Ca₃(PO₄)₂:
100% – 20% = 80%
31 т × 0,8 = 24,8 т
По уравнению:
(Ca₃(PO₄)₂ + 3H₂SO₄ → 2H₃PO₄ + 3CaSO₄)
M(Ca₃(PO₄)₂) = 310 г/моль
M(H₃PO₄) = 98 г/моль
Из 310 г фосфата → 2 × 98 = 196 г кислоты
Составим пропорцию:
310 г → 196 г
24,800,000 г → x
x = (24,800,000 × 196) / 310 ≈ 15,680,000 г = 15,68 т
Ответ: из 31 т смеси можно получить 15,68 т фосфорной кислоты.
4. Раствор фосфорной кислоты массой 49 г с массовой долей H₃PO₄ 50 % нейтрализован гидроксидом кальция. Определите массу образовавшегося фосфата кальция.
Масса чистой кислоты:
w = 50%, m = 49 г
m(H₃PO₄) = 49 × 0,5 = 24,5 г
M(H₃PO₄) = 98 г/моль
n = 24,5 / 98 = 0,25 моль
По уравнению:
(2H₃PO₄ + 3Ca(OH)₂ → Ca₃(PO₄)₂ + 6H₂O)
0,25 моль H₃PO₄ → 0,25 / 2 = 0,125 моль Ca₃(PO₄)₂
M(Ca₃(PO₄)₂) = 310 г/моль
m = 0,125 × 310 = 38,75 г
Ответ: масса образовавшегося фосфата кальция — 38,75 г
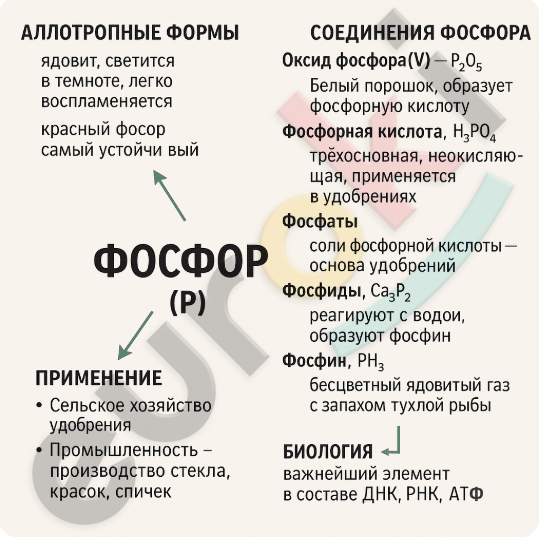
5. Составьте инфографику о фосфоре и его соединениях.