Решебник по химии 9 класс. Рудзитис ФГОС §33
§33
Характеристика углерода и кремния. Аллотропия углерода
Стр. 130
Вопросы
1. Вспомните строение кристаллических решёток алмаза и графита.
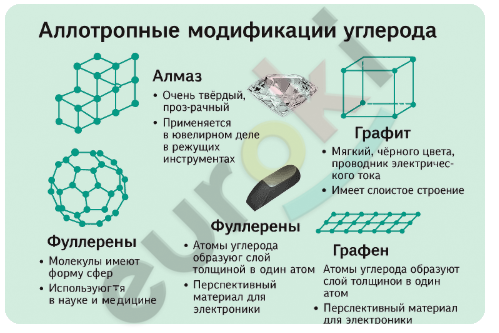
В алмазе кристаллическая решётка представляет собой трёхмерную структуру: каждый атом углерода связан с четырьмя другими прочными ковалентными связями, направленными в вершины тетраэдра. Такое строение делает алмаз очень твёрдым веществом, не проводящим электрический ток.
В графите атомы углерода соединены с тремя соседними в плоской шестиугольной сетке, образуя слои. Четвёртый электрон остаётся свободным, что обеспечивает электропроводность. Слои удерживаются между собой слабыми силами, благодаря чему графит легко расслаивается и используется, например, в карандашах и как смазка.
Стр. 133
Подумай, ответь, выполни
1. Перечислите химические элементы IVA-группы Периодической системы Д. И. Менделеева. Найдите общие и отличительные черты в строении атомов этих элементов.
В главной подгруппе IVA-группы находятся углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb). Эти элементы обладают общим свойством — на внешнем энергетическом уровне у всех из них находится по четыре электрона. Это обуславливает их способность проявлять степень окисления +4, а также, в некоторых случаях, и +2. Общим является также строение внешнего электронного слоя — наличие двух s- и двух p-электронов. Отличие между элементами заключается в числе энергетических уровней: углерод — элемент второго периода, кремний — третьего, и так далее. С увеличением атомного номера возрастают размеры атомов и изменяются физические свойства. Углерод и кремний чаще проявляют неметаллические свойства, а германий, олово и свинец — всё больше металлические.
2. Как доказать, что графит и алмаз являются аллотропными видоизменениями одного и того же химического элемента? Почему их свойства столь различны?
Графит и алмаз состоят из атомов одного и того же элемента — углерода. Это можно доказать с помощью анализа химического состава: при сгорании и графит, и алмаз дают одинаковое количество углекислого газа (CO₂), что указывает на их одинаковую природу. Различие в свойствах объясняется строением: в алмазе каждый атом углерода связан с четырьмя другими прочными ковалентными связями, образуя прочную трёхмерную кристаллическую решётку, что делает алмаз очень твёрдым веществом. В графите же атомы углерода образуют слои, в которых каждый атом связан с тремя другими, а четвёртый электрон остаётся подвижным — это придаёт графиту мягкость, скользкость и электропроводность. Таким образом, одинаковый химический элемент может существовать в разных формах благодаря разному расположению атомов в кристаллической решётке.
3. Для каких целей применяют алмаз и графит?
Алмаз применяется в ювелирной промышленности благодаря своей прозрачности и блеску, а также в промышленности для резки и шлифовки твёрдых материалов — из-за его исключительной твёрдости. Кроме того, алмазы используют в оптических приборах, в буровом оборудовании и даже в медицине — в особо точных инструментах. Графит применяют как смазку, в производстве карандашей, в литейном производстве, как материал для изготовления тиглей, а также как электродный материал благодаря его проводимости. Также графит входит в состав некоторых пластиков и композиционных материалов.
4. Составьте инфографику на одну из тем: «В мире алмазов», «Искусственные алмазы», «Аллотропные модификации углерода», «Современные материалы на основе углерода».